Indhold
- retninger
- Antal elektroner i valenslaget
- Lewis struktur
- Formel ladning af hvert atom
- advarsel
- Hvad du har brug for
Ved bestemmelse af den formelle ladning af et molekyle, såsom CoCl2 (phosgen gas) er det nødvendigt at kende antallet af elektroner i valenslaget af hvert atom og molekylets Lewis-struktur.
retninger

-
Se efter hvert atom i elementernes periodiske tabel for at bestemme antallet af elektroner i valenslaget.
-
Husk at to elektroner er i det første underniveau s, to er i det andet underniveau s, seks elektroner i det første underniveau p, og så videre. Recall: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Hit lasten. Hvis molekylet er en ion, tilføj eller subtrahere en eller flere elektroner fra totalen for at nå den endelige ladning.
-
For CoCl2 (phosgen gas): C = 4; O = 6; Cl = 7. Molekylet er ikke ioniseret og har en neutral ladning. Derfor er det samlede antal elektroner i valenslaget 4 + 6 + (7x2) = 24.
Antal elektroner i valenslaget
-
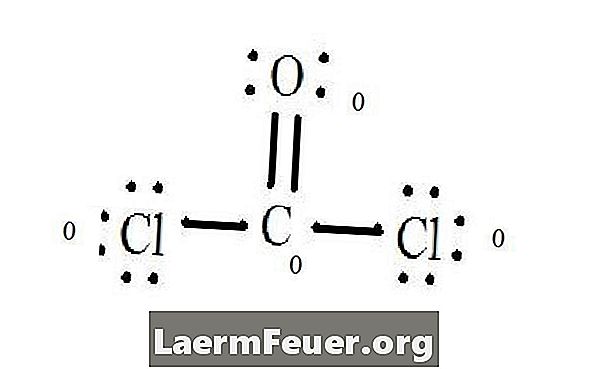
Se Lewis struktur diagrammet af CoCl2 (phosgen gas). Lewis-strukturen repræsenterer den mest stabile og sandsynlige struktur for molekylet. Atomer er tegnet med parrede valenselektroner; bindinger dannes mellem fri elektroner for at tilfredsstille oktetreglen.
-
Tegn hvert atom og dets valenselektroner og dernæst danne bindinger efter behov.
Elektroner trukket på Lewis strukturen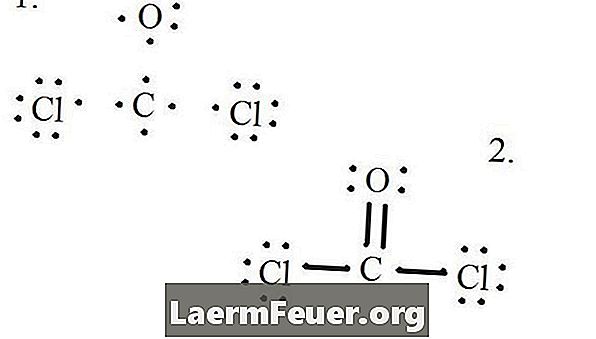
-
Kloridatomer deler enkeltbindinger med carbonmolekylet, mens iltet danner dobbeltbinding med kulstof. Hvert atom i den endelige struktur opfylder oktetreglen og har otte elektroner i valenslaget, hvilket muliggør molekylær stabilitet.
Lewis struktur
-
Tæl de frie elektronpar af hvert atom i Lewis-strukturen. Hvert atom betegner en elektron af hver bånd, hvorfra den deltager. Tilføj disse tal. I CoCl2: C = 0 frie par plus 4 bindingselektroner = 4 elektroner. O = 4 elektroner af frie par plus 2 elektroner af obligationer = 6 elektroner. Cl = 6 elektroner af frie par plus en elektron af en binding med C = 7 elektroner.
-
Subtrahere mængden af antallet af elektroner i valenslaget på det ubundne atom. Resultatet er den formelle afgift for hvert atom. I CoCl2: C = 4 valenceelektroner (ev) i det ubundne atom minus 4 elektroner udpeget i Lewis-strukturen (LS) = 0 formel ladning O = 6 ev - 6 LS = 0 formel ladning Cl = 7 og -7 LS = 0 formelle gebyr
Formelle ladninger af atomer
-
Når du skriver, placer disse afgifter nær atomer i Lewis-strukturen. Hvis molekylet i alt har en ladning, skal du placere Lewis-strukturen i parentes med ladningen, der er skrevet på ydersiden i øverste højre hjørne.
Formel ladning af hvert atom
advarsel
- Beregningen af den formelle afgift for molekyler indeholdende overgangsmetaller kan være forræderisk. Antallet af elektroner i valenslaget for overgangsmetaller vil være dem ud af ædelgasmønsteret.
Hvad du har brug for
- Periodisk tabel af elementerne